BS. Đặng Tiến Dũng
Bác sĩ Khoa Ngoại Tổng Quát – Tiết Niệu – Ung Bướu
Bệnh viện Đa khoa Hồng Hưng, Tây Ninh
Hóa trị là phương pháp điều trị ung thư phổ biến nhất, thường được sử dụng kết hợp với các liệu pháp khác, chẳng hạn như phẫu thuật, xạ trị, liệu pháp trúng đích hoặc liệu pháp hormone.
 Các loại thuốc hóa trị và đường dùng
Các loại thuốc hóa trị và đường dùng
Các thuốc hóa trị có thể được phân loại thành các nhóm khác nhau, chẳng hạn như: các tác nhân alkyl hóa (cisplatin, carboplatin), các chất chống chuyển hóa (5-flourouracil, methotrexate), chất ức chế topoisomerase (etoposide, irinotecan), chất ức chế thoi phân bào/ alkaloid thực vật (paclitaxel, vincristine) và một số loại chất gây độc tế bào khác như kháng sinh (doxorubicin, bleomycin).
Thuốc hóa trị có thể dùng theo nhiều đường, trong đó, phổ biến nhất là đường tĩnh mạch và đường uống.
Các tác dụng phụ gây ra bởi hóa trị
Tất cả các loại thuốc hóa trị đều có cơ chế hoạt động riêng biệt tác động lên chu kỳ tế bào. Thật không may, những nhóm thuốc này thiếu tính chọn lọc và sẽ làm thương tổn các tế bào đang phát triển ở cả quần thể ung thư lẫn tế bào bình thường. Nó dẫn đến các tác dụng cấp tính xảy ra trong thời gian điều trị và các tác dụng phụ kéo dài sau đó. Tủy xương, niêm mạc đường tiêu hóa, nang lông và tuyến sinh dục là một trong những mô nhạy cảm nhất trong cơ thể liên quan đến sự phá hủy các tế bào đang phân chia nhanh chóng. Vì vậy, các tác dụng phụ phổ biến nhất sẽ xuất hiện trên các cơ quan này. Bệnh nhân sẽ bị suy tủy, buồn nôn, nôn, rụng tóc và ảnh hưởng đến hệ sinh dục. Quá trình sinh tinh và sinh trứng bị ảnh hưởng dẫn đến giảm khả năng sinh sản. Mặt khác, phần lớn các hóa chất gây độc tế bào đều gây quái thai và có khả năng gây hại cho thai nhi.
Các tác dụng phụ phổ biến khác có liên quan đến hầu hết các loại thuốc hóa trị như mệt mỏi, chán ăn, đau cơ hoặc thậm chí là đau đầu. Các tác dụng phụ gặp phải rất khác nhau, tùy thuộc vào nhiều yếu tố. Loại thuốc là một trong những yếu tố chính, mức độ ảnh hưởng tùy theo tuổi bệnh nhân, giới tính, tình trạng sức khỏe tổng thể và loại ung thư. Các yếu tố khác không nên bỏ qua như liều lượng và thời gian điều trị. Dưới đây là một số tác dụng phụ thường gặp do hóa trị, các cách phòng ngừa và xử trí.
Sốt giảm bạch cầu trung tính
Sốt giảm bạch cầu trung tính (Febrile neutropaenia – FN) được định nghĩa là nhiệt độ đo ở miệng >38,3°C hoặc hai lần đo liên tiếp >38,0°C trong 2 giờ và và số lượng bạch cầu trung tính tuyệt đối (ANC) <0,5×109/l hoặc dự kiến giảm xuống dưới 0,5×109/l.
Mặc dù có những tiến bộ lớn trong phòng ngừa và điều trị, sốt giảm bạch cầu trung tính vẫn là một trong những biến chứng thường xuyên và nghiêm trọng nhất của hóa trị ung thư. Đây là nguyên nhân chính gây tăng gánh nặng bệnh tật, tăng sử dụng nguồn lực chăm sóc sức khỏe và làm giảm hiệu quả điều trị do trì hoãn và giảm liều hóa trị. Tỷ lệ tử vong do FN đã giảm dần nhưng vẫn còn đáng kể. Hầu hết các phác đồ hóa trị với liều tiêu chuẩn đều gây giảm bạch cầu trung tính từ 6 – 8 ngày và FN được thấy ở ∼ 8 trường hợp trên 1.000 bệnh nhân ung thư được hóa trị. Khoảng 20% – 30% trường hợp FN có biến chứng yêu cầu quản lý nội trú, với tỷ lệ tử vong nội viện ∼ 10%. Chi phí trung bình cho mỗi lần nhập viện tại các nước phương Tây là ∼13.500 EUR (15.000 USD). Hiện tại, dựa theo tỉ lệ xảy ra FN, các phác đồ hóa trị được phân chia thành nhóm nguy cơ cao (>20%), nguy cơ trung bình (10% – 20%) hoặc nguy cơ thấp (<10%).
Ngoài bản thân phác đồ hóa trị, các yếu tố từ bệnh nhân cũng làm tăng nguy cơ FN và các biến chứng của nó. Trong đó, tuổi tác đóng vai trò chủ yếu, ngoài ra còn các yếu tố khác như: bệnh ở giai đoạn tiến triển, có tiền sử bị FN trước đó, không được dự phòng bằng kháng sinh hoặc yếu tố kích thích dòng bạch cầu hạt (G-CSF Granulocyte colony-stimulating factor), viêm niêm mạc, chỉ số toàn trạng kém và/ hoặc mắc bệnh tim mạch.
Thuốc kháng sinh (fluoroquinolones) đã được sử dụng trong một thời gian dài để dự phòng FN ở những bệnh nhân được hóa trị. Cách tiếp cận này đã phần nào thành công nhưng cũng dẫn đến sự xuất hiện của các chủng kháng thuốc, làm hạn chế hiệu quả của nó.
Một số phân tích tổng hợp chỉ ra rằng điều trị dự phòng nguyên phát bằng G-CSF (tức là G-CSF được sử dụng ngay sau chu kỳ hóa trị đầu tiên, khác với dự phòng thứ phát – bắt đầu dùng G-CSF khi chu kỳ trước đó đã xảy ra FN) giảm nguy cơ FN ít nhất 50% ở những bệnh nhân bị mắc u đặc mà không ảnh hưởng đáng kể đến đáp ứng của khối u hoặc thời gian sống còn.
Hầu hết các hướng dẫn điều trị trên thế giới hiện nay đều khuyến nghị dự phòng bằng G-CSF nếu nguy cơ FN >20% cho tất cả các chu kỳ đã lên kế hoạch điều trị [I, A]. Đối với những bệnh nhân có nguy cơ trung bình (10% – 20%), điều quan trọng là phải xem xét tuổi của bệnh nhân và đặc biệt là bất kỳ bệnh đồng mắc nào. Bên cạnh đó, G-CSF có thể được xem xét ở những bệnh nhân bị giảm dự trữ tủy xương do trước đó đã trải qua xạ trị với thể tích vùng chiếu xạ lớn hoặc bệnh nhân giảm bạch cầu trung tính trong bối cảnh nhiễm HIV. Ở Việt Nam, 2 loại G-CSF thường được sử dụng là filgrastim và pegfilgrastim.

Hình 1: Sơ đồ để quyết định việc sử dụng yếu tố kích thích dòng bạch cầu hạt để dự phòng nguyên phát sốt giảm bạch cầu trung tính do hóa trị – Hướng dẫn của Tổ chức Nghiên cứu và Điều trị Ung thư Châu Âu.
Thiếu máu
Thiếu máu và thiếu sắt là những tình trạng thường gặp ở bệnh nhân có ung thư huyết học và ung thư dạng bướu đặc, nhất là trên những bệnh nhân được điều trị bằng các tác nhân hóa trị liệu. Thông thường, thiếu máu có liên quan đến mệt mỏi, suy giảm các chức năng của cơ thể và giảm chất lượng sống. Hậu quả thiếu máu có thể bao gồm đáp ứng kém với điều trị ung thư và giảm tỷ lệ sống còn toàn bộ, mặc dù điều này chưa chắc chắn. Các nguyên nhân cơ bản gây thiếu máu chủ yếu là suy giảm hoạt động tạo hồng cầu và rối loạn cân bằng nội môi sắt, có thể là hậu quả của việc tăng giải phóng các cytokine gây viêm do ung thư tiềm ẩn và/ hoặc độc tính của liệu pháp điều trị ung thư. Hơn nữa, thiếu hụt vitamin B12 và folate là những nguyên nhân gây thiếu máu tương đối hiếm gặp ở bệnh nhân ung thư.
Thiếu sắt ở những bệnh nhân có khối u ác tính được xác định là do không đủ sắt cho các chức năng của tế bào, nổi bật nhất là tổng hợp haem để tạo hồng cầu. Thiếu sắt tuyệt đối (absolute iron deficiency), sắt dự trữ đã cạn kiệt, trong khi thiếu sắt chức năng (functional iron deficiency) phản ánh tình trạng thiếu sắt mặc dù các kho dự trữ sắt còn đầy; điều này có thể là do sắt bị cô lập trong kho dự trữ sắt hoặc tăng nhu cầu sắt trong quá trình điều trị với erythropoietin. Ở bệnh nhân ung thư, thiếu sắt tuyệt đối chủ yếu là do chảy máu, trong khi các nguyên nhân khác như tái hấp thu sắt không đủ ở ruột (do dinh dưỡng kém), thường chiếm phần nhỏ. Quan trọng nhất, cân bằng nội môi sắt ở bệnh nhân ung thư thường bị suy giảm thông qua việc giải phóng các cytokine tiền viêm và tăng hepcidin – chất điều hòa chính của sự hấp thu và giải phóng sắt. Nồng độ hepcidin tăng dẫn đến thiếu sắt chức năng do tác động lên ferroportin – đóng các kênh vận chuyển sắt trên tế bào ruột khiến giảm hấp thu sắt từ ruột, đồng thời cũng đóng các kênh này trên màng đại thực bào và tế bào gan, khiến sắt không thể giải phóng được và tiếp tục bị dự trữ trong các tế bào này dưới dạng ferritin; điều này làm cho sắt trong huyết thanh giảm và ferritin tăng.
Sơ đồ bên dưới chủ yếu đề cập đến các phương pháp điều trị thiếu máu trên bệnh nhân ung thư đang hóa trị bao gồm: sử dụng chất kích thích tạo hồng cầu (ESAs), sắt tĩnh mạch hoặc uống, truyền hồng cầu và kết hợp các phương pháp điều trị này.
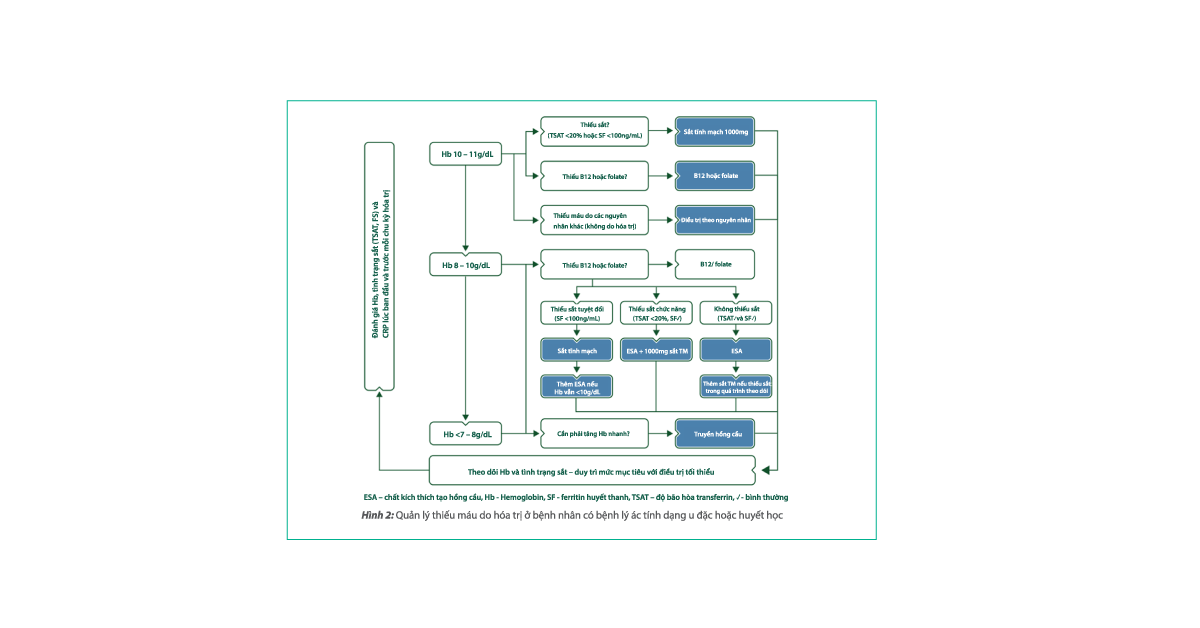
Hình 2: Quản lý thiếu máu do hóa trị ở bệnh nhân có bệnh lý ác tính dạng u đặc hoặc huyết học

Buồn nôn và nôn
Mặc dù đã đạt được những tiến bộ đáng kể trong 30 năm qua (từ những thập niên 1990), nôn và đặc biệt là buồn nôn, tiếp tục là hai trong số những tác dụng phụ đáng lo ngại nhất của hóa trị liệu ung thư.
Các thuốc ung thư tĩnh mạch được chia thành 4 nhóm dựa theo mức độ gây nôn: cao (nguy cơ nôn >90%), trung bình (30% – 90%), thấp (10% – 30%) và tối thiểu (<10%).
Nguy cơ buồn nôn/ nôn (cấp tính <24 giờ, muộn >24 giờ) đối với những người dùng thuốc chống ung thư kéo dài ít nhất 3 ngày với thuốc hóa trị có nguy cơ gây nôn cao và 2 ngày với thuốc hóa trị có nguy cơ gây nôn trung bình. Bệnh nhân cần được dự phòng trong suốt thời gian này. Đối với các phác đồ hóa trị có nguy cơ gây nôn cao và trung bình, có thể phối hợp từ 2 – 4 nhóm thuốc sau:
- Olanzapine
- Thuốc đối kháng thụ thể Neurokinin 1 (NK1 RA): aprepitant…
- Thuốc đối kháng thụ thể 5-HT3 (5-HT3 RA): ondansetron, granisetron, palonosetron…
- Dexamethasone
Đối với các phác đồ hóa trị có nguy cơ gây nôn thấp, có thể xem xét dự phòng bằng một thuốc chống nôn duy nhất chẳng hạn như dexamethasone, 5-HT3 RA hoặc chất đối kháng thụ thể dopamin như metoclopramide.
Đối với các phác đồ hóa trị có nguy cơ gây nôn tối thiểu, không cần dự phòng bằng thuốc chống nôn.
Nếu một bệnh nhân bị buồn nôn hoặc nôn với phác đồ có nguy cơ gây nôn thấp/ tối thiểu: xem xét nâng mức độ chống nôn ở chu kỳ hóa trị tiếp theo.
Hội chứng bàn tay – bàn chân
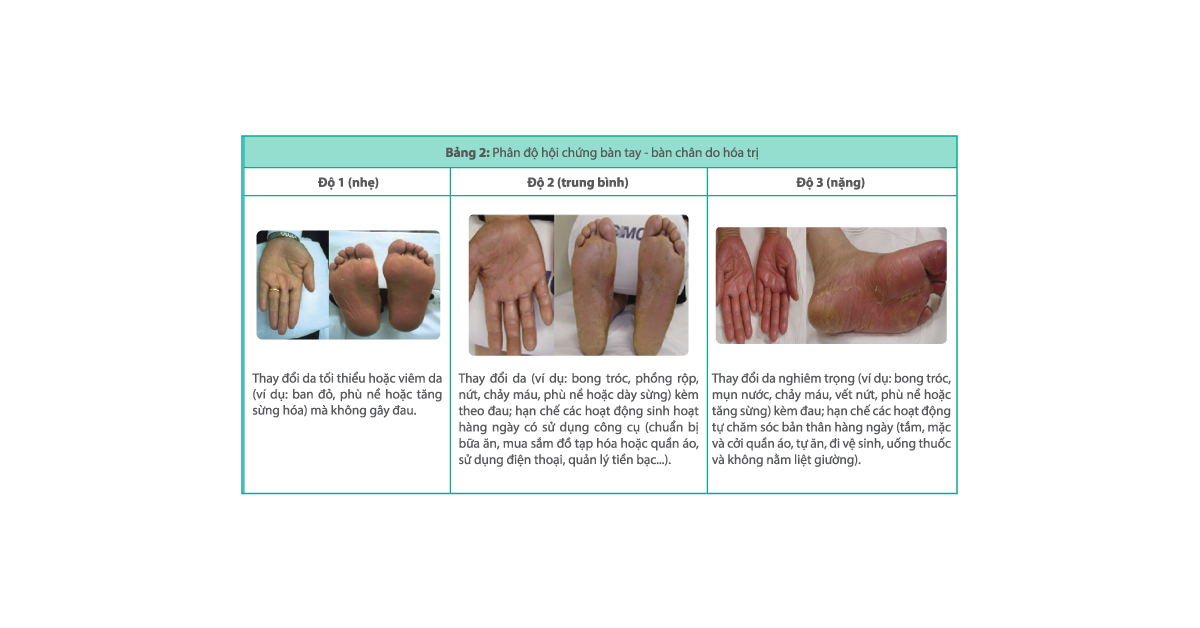
Hội chứng bàn tay – bàn chân (Hand-foot syndrome), còn được gọi là rối loạn cảm giác ban đỏ ở lòng bàn tay – bàn chân (palmar-plantar erythrodysaesthesia) là một tác dụng phụ thường gặp liên quan đến một số loại thuốc hóa trị bao gồm: capecitabine, fluorouracil, liposomal doxorubicin và cytarabine. Một phản ứng tương tự, phản ứng da tay – chân (hand-foot skin reaction) xảy ra với một số chất ức chế kinase, ví dụ: pazopanib, sorafenib và sunitinib, tuy nhiên tổn thương có xu hướng khu trú hơn và dày sừng hơn. Hội chứng bàn tay – bàn chân được đặc trưng bởi sự xuất hiện dần dần của các phản ứng đối xứng hai bên trên lòng bàn tay và lòng bàn chân bao gồm ban đỏ, nhạy cảm, đau, sưng, râm ran, tê, tăng sắc tố, ngứa, tổn thương bóng nước, phát ban khô, bong vảy ẩm, loét và giảm cảm giác hoặc dị cảm. Mặc dù không đe dọa đến tính mạng nhưng hội chứng bàn tay – bàn chân ảnh hưởng đến chất lượng cuộc sống và có thể dẫn đến việc giảm liều thuốc hóa trị xuống dưới mức tối ưu. Các triệu chứng dường như phụ thuộc vào liều lượng và lòng bàn tay bị ảnh hưởng nhiều hơn lòng bàn chân.
Hội chứng bàn tay – bàn chân có thể xảy ra vài ngày đến vài tuần sau khi bắt đầu điều trị bằng một số loại thuốc hóa trị. Nó thường phát triển nhất sau sáu tuần điều trị. Các triệu chứng thường hết trong vòng hai tuần nếu ngừng thuốc hóa trị.
Phòng ngừa
- Dùng corticosteroid đường uống/ bôi trước hóa trị;
- Sử dụng các tác nhân tại chỗ như kem làm mềm tại chỗ, kem gốc urê hoặc kem vitamin E;
- Miếng dán nicotin;
- Thuốc ức chế COX-2 trong một số trường hợp;
- Tránh để bàn tay và bàn chân tiếp xúc với sức nóng và/ hoặc áp lực không cần thiết;
- Làm mát tay chân trong quá trình điều trị;
- Pyridoxine đường uống không hiệu quả trong điều trị dự phòng.
Điều trị
- Giảm liều và/ hoặc tăng khoảng cách dùng thuốc hóa trị;
- Ngừng thuốc hóa trị;
- Bôi tại chỗ kem làm mềm da có chứa urê 10%;
- Dùng thuốc giảm đau thường xuyên hoặc theo nhu cầu;
- Cân nhắc khám bác sĩ da liễu nếu triệu chứng còn dai dẳng.
Lời khuyên dành cho bệnh nhân
Các biện pháp can thiệp sau đây có thể hỗ trợ làm giảm sự phát triển và mức độ nghiêm trọng của hội chứng tay chân cũng như giảm đau, khó chịu và nhiễm trùng thứ phát do hội chứng bàn tay – bàn chân. Bệnh nhân được khuyên nên:
- Thoa nhẹ nhàng chất làm mềm lên tay và chân hàng ngày; ví dụ như chất làm mềm có chứa urê 10%. Các chế phẩm có chứa urê làm ẩm da bằng cách giảm mất nước từ lớp biểu bì (lớp trên của da) giúp da mềm mại và dẻo dai hơn;
- Tắm bằng nước ấm;
- Có thể ngâm tay và chân vào chậu nước lạnh 15 phút, khoảng 3 đến 4 lần/ ngày;
- Tránh tiếp xúc với ánh nắng mặt trời và sử dụng kem chống nắng SPF 30+ hoặc cao hơn;
- Tránh các hoạt động gây cọ xát quá mức trên bề mặt da;
- Sử dụng găng tay khi xử lý các hóa chất như chất tẩy rửa;
- Đeo găng cotton để bảo vệ da;
- Mang vớ cotton dày đặc biệt nếu đứng trong thời gian dài;
- Tránh mang giày chật;
- Tránh các loại kem có chứa chất gây tê tại chỗ vì chúng có thể làm trầm trọng thêm tình trạng nhiễm độc da;
- Tránh để bàn tay và bàn chân tiếp xúc với nhiệt độ cao;
- Thông báo với bác sĩ khi có bất kỳ thay đổi nào về da càng sớm càng tốt.
Kết luận
Các thuốc hóa trị ung thư đã được dùng từ lâu và vẫn chưa thể thay thế trong việc điều trị phần lớn các bệnh ung thư cho dù gần đây có sự bùng nổ của các nhóm thuốc nhắm trúng đích, miễn dịch… Vì ảnh hưởng không chọn lọc lên cả tế bào ác tính và tế bào lành, nên tác dụng phụ do hóa trị là điều khó tránh khỏi. Điều này làm giảm chất lượng sống, giảm hiệu quả điều trị, thậm chí ảnh hưởng nghiêm trọng đến sức khỏe người bệnh. Do đó, việc dự phòng và quản lý các tác dụng phụ của hóa trị cần được xem xét trước khi quyết định một chiến lược điều trị cho bệnh nhân.
Tài liệu tham khảo
- Side effects of chemotherapy and their management- Emma Appel – Microreviews in Cell and Molecular Biology (2023)
- Management of febrile neutropaenia: ESMO Clinical Practice Guidelines (2016)
- Management of anaemia and iron deficiency in patients with cancer: ESMO Clinical Practice Guidelines (2018)
- 2016 MASCC and ESMO guideline update for the prevention of chemotherapy- and radiotherapy-induced nausea and vomiting and of nausea and vomiting in advanced cancer patients (2016)
- Management of cytotoxic chemotherapy-induced hand-foot syndrome -Johannes J.M. Kwakman at al – Oncology Reviews 2020; volume 14:442
Bài viết thuộc Bản tin Y tế Hồng Hưng | Số 3 – năm 2023,
Chủ đề: SỬ DỤNG THUỐC HỢP LÝ
(Xem toàn bộ bản tin: Tại đây)
